Les cellules CAR-T, nouvelles armes contre le cancer

Le mot préféré d’un chercheur en immunologie ? Spécificité ! Car être spécifique, c’est pouvoir reconnaître une protéine ou une cellule et ainsi pouvoir mieux l’étudier ou l’éliminer… Dans le cas de la leucémie, un pas immense vient d’être franchi en créant des cellules spécifiques encore plus puissantes que votre système immunitaire : les cellules CAR-T (des lymphocytes T portant un récepteur chimérique) !
Le lymphocyte T, très spécifique et présent en grand nombre
Lors d’une réaction immunitaire contre un pathogène (virus, bactérie…) ou contre une cellule cancéreuse, les lymphocytes vont être « éduqués » à reconnaître des antigènes, c’est-à-dire une petite partie d’un composé considéré comme étranger par l’organisme (cf. Qu’est-ce qu’un anticorps). Parmi les lymphocytes, certains sont appelés lymphocytes T. Contrairement aux lymphocytes B, ils ne ne produisent pas d’anticorps mais possèdent un récepteur appelé TCR(1) qui lui aussi peut être spécifique d’un antigène. Les lymphocytes T agissent de plusieurs façons : ils peuvent détruire les cellules reconnues (on parle de lymphocyte T cytotoxique) ou stimuler d’autres cellules immunitaires (on parle de lymphocyte T helper). Ainsi, ils participent à l’élimination des cellules exprimant les antigènes reconnus.
Nous avons des millions de lymphocytes T dans notre sang et dans nos organes ! Ils patrouillent à chaque instant, à la recherche de leur antigène et donc leur cible, prêts à l’éliminer…
Ces cellules qui échappent au contrôle immunitaire…
Malheureusement, les cellules cancéreuses sont très vicieuses et ont mis en place des mécanismes de défense contre cette réponse immunitaire : elles expriment des récepteurs inhibiteurs. Ce sont des molécules inactivant les lymphocytes T qui essayent de les détruire. Ainsi, les lymphocytes T ne reconnaissent plus ces cellules et donc ne stimulent plus le reste du système immunitaire… On parle d’immuno-évasion : les cellules cancéreuses échappent à la surveillance du système immunitaire.
Un lymphocyte T toujours plus spécifique et plus fort
Afin d’éviter ces problèmes, les chercheurs ont imaginé modifier artificiellement les lymphocytes T pour qu’ils soient en plus grand nombre et submergent les cellules cancéreuses afin d’empêcher leur évasion. Pour cela, rien de très compliqué : les chercheurs ont créé un récepteur chimérique(2), le CAR, qu’ils peuvent faire exprimer par des lymphocytes T préalablement isolés à partir du sang du patient. Ce récepteur reconnait spécifiquement une molécule exprimée par les cellules cancéreuses et permet d’activer le lymphocyte T. De plus, les chercheurs ont couplé ce récepteur chimérique à des co-récepteurs activateurs qui vont amplifier le signal d’activation et ainsi contrer les molécules inhibitrices exprimées par les cellules cancéreuses. Ces lymphocytes CAR-T sont ensuite réinjectés en grand nombre dans le sang du patient, prêts à combattre en nombre et en force les cellules cancéreuses !
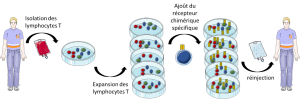
Les résultats publiés par plusieurs équipes américaines ont démontré l’efficacité de ces traitements avec la disparition totale des cellules leucémiques dans 70 à 90% des cas. De plus, les lymphocytes T modifiés étant issus du patient, ils ne sont pas rejetés (comme lors d’une greffe d’organe). Ils persistent très longtemps dans le sang du patient, patrouillant en quête de cellules cancéreuses résiduelles. De nombreux essais cliniques sont en cours afin d’évaluer l’utilisation des cellules CAR-T dans d’autres cancers. Une seule condition à remplir : il faut avoir une protéine à cibler et donc connaître celle exprimée par la cellule cancéreuse à éliminer.
(1) récepteur des lymphocytes T (T-cell receptor).
(2) une construction artificielle entre plusieurs molécules.
Sources:
– Opinion: Balancing Risks and Rewards of CAR T-Cell Therapy, David Harris. The Scientist 15 décembre 2016
– The Principles of Engineering Immune Cells to Treat Cancer, Lim WA, June CH. Cell 2017