La cytométrie en flux

La cytométrie en flux permet d’étudier des particules contenues dans un échantillon. Ces particules peuvent être des cellules, des bactéries, des parasites etc. Pour l’expérience du jour, nous allons nous concentrer sur l’analyse des cellules. Les chercheurs utilisent souvent cette technique pour déterminer leurs caractéristiques : leur taille, leur granulosité(1) et les molécules exprimées au niveau de leur membrane ou dans leur noyau. Des données essentielles pour pouvoir déterminer les proportions des différentes populations cellulaires dans un échantillon sanguin par exemple.
Un principe physique et fluidique
Le principe général de la cytométrie en flux est d’entraîner l’échantillon dans un conduit de façon à faire passer les cellules une par une devant un faisceau lumineux. La machine est constituée d’une buse que l’on plonge dans l’échantillon. A l’intérieur de cette buse, un liquide de gaine est injecté au niveau des parois internes. Une accélération progressive du liquide de gaine permet « d’aspirer » le liquide de l’échantillon et donc d’amener les cellules devant le faisceau lumineux. Le faisceau traverse la cellule puis des capteurs, situés en face, réceptionnent les informations et les transmettent à l’ordinateur sous forme de graphiques.
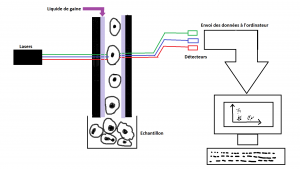
La taille et la granulosité d’une cellule peuvent être déterminées sans manipulation préalable de l’échantillon. Par contre, l’identification des molécules présentes à la surface ou à l’intérieur de la cellule demandent quelques étapes préalables de « marquage » avec des sondes fluorescentes.
Le phénotype, la carte d’identité d’une cellule
Vous avez probablement déjà entendu parler de lymphocytes, monocytes, polynucléaires… lors d’un bilan sanguin par exemple. Il s’agit en fait de populations cellulaires que l’on peut différencier grâce aux molécules qu’elles expriment à leur surface ou dans leur noyau. On appelle phénotype l’ensemble des molécules exprimées par une cellule et qui permettent de la caractériser.
Par exemple, les lymphocytes T(2) expriment généralement la molécule CD3 (CD pour Cluster de Différenciation). Il est ensuite possible de distinguer des sous-populations de lymphocytes T en fonction de l’expression des molécules CD4 ou CD8. On parle alors de lymphocytes T CD4 et lymphocytes T CD8, deux populations bien distinctes qui auront des rôles différents lors d’une réponse immunitaire.
Si on en revient à notre sujet, la cytométrie en flux, le faisceau lumineux n’est sont pas capable de distinguer directement si un CD4 ou un CD8 est exprimé à la surface de la cellule qui passe devant lui. Il faut l’aider un peu en marquant préalablement le mélange cellulaire avec des sondes anti-CD4 et anti-CD8. Bien sûr, ces sondes doivent être fluorescentes pour être détectées par les lasers !
Le protocole
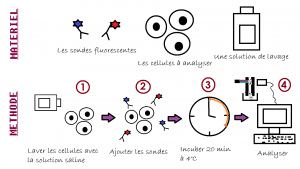
Les sondes fluorescentes sont généralement des anticorps auxquels sont couplés un fluorochrome. Si on reprend l’exemple des lymphoctes T CD4 et CD8, les sondes qui vont être utilisées sont des anticorps anti-CD4 et anti-CD8. Pour pouvoir différencier les deux marqueurs au moment de l’analyse, les anticorps doivent être couplés à des fluorochromes différents. Justement en parlant d’analyse …
L’analyse des données
Si par hasard vous vous promenez dans un laboratoire de recherche, il se peut que vous entendiez au détour d’un couloir :
T’inquiètes je suis dans le timing, je passe au « Fax » à 16h !
Entendez par « Fax » la machine qui sert à analyser les cellules. Il s’agit en fait d’un « FACS » signifiant Fluorescence-activated cell sorting. Une fois l’échantillon de cellules passé devant les lasers, le chercheur obtient ce type d’image sur l’écran de son ordinateur :
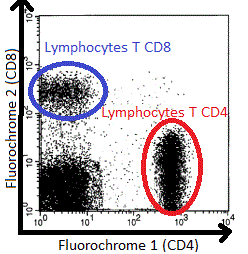
Les points correspondent aux événements détectés par les lasers, c’est à dire les cellules ! Les axes représentent des intensités de fluorescence. Prenons l’axe des abscisses comme exemple : plus les points apparaissent à droite, plus ils ont fixé le fluorochrome 1 correspondant à la molécule CD4. Interprétation : la population de points (donc de cellules) en bas à droite correspond aux lymphocytes T CD4. En principe, dans le sang, les lymphocytes T ne peuvent pas exprimer les molécules CD4 et CD8 en même temps. Il est donc peu probable de retrouver une population en haut à droite dans ce cas de figure.
La cytométrie en flux permet ainsi d’analyser simultanément l’expression de nombreux marqueurs sur une cellule. Attention cependant à ne pas vouloir regarder trop de choses en même temps car cette technique a évidemment ses limites. Par exemple, deux fluorochromes, bien que différents, peuvent avoir des spectres d’émission(3) très proches et donc complexifier l’analyse. Des stratégies existent pour résoudre ce problème mais dans tous les cas les machines ont leur propres limites et il est généralement difficile d’analyser plus de 20 marqueurs en même temps. Si on en veut plus, il y a d’autres techniques comme le cytométrie de masse basée non plus sur la fluorescence mais sur les propriétés des métaux lourds… Mais c’est une autre histoire !
(1) La complexité interne de la cellule.
(2) Qui proviennent du Thymus.
(3) Intensité de fluorescence émise à une longueur d’onde donnée.